네이처셀, 알츠하이머 치매 줄기세포치료제 미국 임상 환자 첫 투여 성공리에 마쳐
- 한국에서 배양 제조하여 미국으로 공수해 투여하는 시스템 적용
- 2018년 상반기 내 환자 60명 투여 완료
- 한국, 금년 11월 조건부 허가 목적 사전 검토 신청
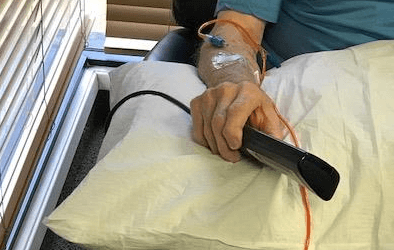
첨단 바이오기업 네이처셀은 미국 FDA 임상승인을 받은 알츠하이머 치매 줄기세포치료제 ‘아스트로스템’을 첫 환자에게 성공적으로 투여했다고 20일 발표하였다.
미국 캘리포니아 오렌지카운티에 소재한 ATP clinic에서 미국인 알츠하이머 치매 환자에게 자가지방줄기세포 2억셀을 2시간 정도의 시간 동안 정맥 내로 안전하게 주입하였다.
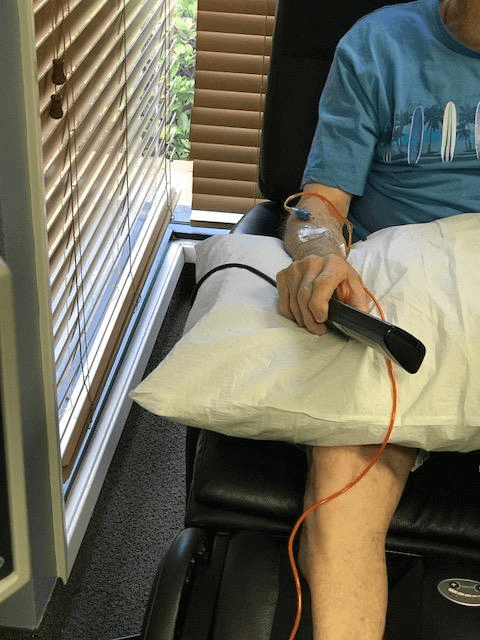
네이처셀은 지난 2016년 11월 미국 FDA로부터 알츠하이머 치매 줄기세포치료제인 아스트로스템에 대한 상업임상 1/2상을 승인 받았으며, 2017년 3월 IRB승인을 받아 미국 내 3개 임상센터에서 환자모집에 들어갔다. 이번 첫 투여 환자는 3개 임상센터 중 하나인 ATP clinic에서 시행되었다. 이 환자는 2주 간격으로 총 10회 아스트로스템을 투여 받게 되며, 10회 투여 3개월 후까지 안전성과 효과를 모니터링 한다.
아스트로스템은 한국의 바이오스타 줄기세포연구원에서 개발한 자가지방줄기세포 치료제이다. 환자의 정맥 내로 투여되므로 투여방법이 간편하고 안전하다. 지금까지 치매 치료제의 기전과 달리 항염증, 뇌혈관 재생, 뇌신경세포 보호, 뇌신경세포 재생 작용, 아밀로이드 단백질 침착 감소와 같은 다기능을 통해 작용한다. 이미 알츠하이머 치매 모델 동물에서 예방 및 치료 효과가 확인되어 저명 국제 학술지인 Plos-One에 발표된 바 있다.
이번 첫 미국 알츠하이머 치매 환자 대상 아스트로스템의 성공적 투여는 바이오스타 줄기세포연구원 줄기세포 기술의 집약이라고 할 수 있다.
첫째, 한국에서 배양, 제조한 살아있는 상태의 줄기세포를 미국으로 공수하여 안전하게 투여할 수 있는 기술 개발이 있었기에 가능했다. 전 세계적으로 살아있은 세포치료제의 유통기간은 최대 3일이지만 아스트로스템은 7일 이상 생존율이 90%이상 유지되는 신제형 기술이 적용되었다. 현재, 이 기술은 한국을 포함한 전 세계에 특허 출원 및 등록되었다.
둘째, 줄기세포의 크기를 혈관 내 투여가 가능하도록 작게 배양하는 기술이 적용되었다. 이 기술은 한국, 미국, 유럽 등 전 세계에 특허가 등록되어 기술의 신규성과 진보성이 인정되었다.
네이처셀은 2018년 상반기 내 FDA로부터 승인 받은 60명의 환자에게 모두 투여를 마치고 2018년 말까지 결과를 발표한다는 계획이다.
한국의 경우 11월 말까지 미국 임상 초기 3명 환자 대상 초기 안전성을 평가한 후 조건부 허가 목적으로 임상시험 계획에 대한 식약처 사전 검토 신청할 예정이다.
알츠하이머치매 줄기세포 치료제 개발책임자인 바이오스타 줄기세포 기술원장 라정찬 박사는 “지난 12년간 발전시킨 성체줄기세포기술이 집약되어 적용되는 적응증이 알츠하아머 치매이다. 자가지방줄기세포를 젊고 안전하게 배양하는 기술, 작게 배양하는 기술, 암세포를 억제하는 기술, 살아있은 상태의 줄기세포를 9일까지 90% 이상 생존케 하는 기술이 개발되었기에 미국 알츠하이머치매 환자에 대한 성공적 투여가 가능했다. 그 동안 함께 기술개발에 동참한 연구원들의 노고에 감사하며 이번 임상을 통해 치매 정복의 가능성이 확인되기를 기대한다.”고 소감을 밝혔다.




Leave a reply